

Come proteggere il dispersore dalla corrosione (1/2)
1. Processi di corrosione
Dal punto di vista chimico-fisico i metalli e le leghe, nelle normali condizioni ambientali, non sono in equilibrio ma tendono a trasformarsi nei loro composti: ossidi, idrossidi, carbonati, solfati, cloruri ecc. Si tratta di processi di alterazione cui sono soggetti quasi tutti i metalli, ad eccezione dei cosiddetti metalli nobili, come il platino, l'oro e l'argento, e che si manifestano in seguito ad ossidazione della superficie a contatto con l'ambiente.
Alla base di questo fenomeno, chiamato corrosione, vi è quasi sempre lo scambio di elettroni fra una specie chimica che li cede (ossidazione) ed una seconda specie chimica che li acquista (riduzione). In questa reazione, detta appunto di ossidoriduzione, la specie chimica che si corrode è quella che perde elettroni. Non sempre però l'ossidazione conduce alla corrosione. Certi metalli assumono un comportamento, detto passivazione, nel quale si ha la formazione di alcuni prodotti di corrosione non solubili, in genere ossidi, che aderendo intimamente alla superficie del metallo ostacolano il processo di corrosione che si sviluppa quindi molto più lentamente.
Due sono i meccanismi fondamentali secondo i quali si esplica la corrosione dei metalli:
- corrosione chimica
- corrosione elettrochimica.
1.1 Corrosione chimica
La corrosione chimica consiste in una reazione tra un metallo e un liquido o tra un metallo e un gas, come ad esempio il ferro che reagisce a certe temperature con l'ossigeno presente nell'atmosfera producendo i suoi ossidi (fig. 1). In questo caso il metallo cede elettroni all'ossigeno con formazione di ioni metallo carichi positivamente e ioni ossigeno carichi negativamente che si legano determinando la formazione di uno strato, più o meno aderente alla superficie, di prodotti della corrosione. Il processo non è generalmente accompagnato da passaggio di corrente elettrica.
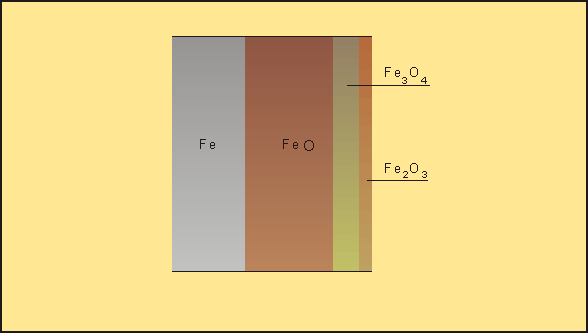
Fig. 1 - La corrosione di tipo chimico avviene a causa della reazione tra un metallo e un liquido o tra un metallo e un gas
1.2 Corrosione elettrochimica
La corrosione elettrochimica può avvenire, quando i metalli sono immersi in un elettrolita, a temperatura prossima a quella ordinaria attraverso due reazioni principali, una all'anodo ed una al catodo (fig. 2):
- le reazioni anodiche sono reazioni di ossidazione che tendono a distruggere il metallo dell'anodo che si discioglie sottoforma di ioni oppure ritorna allo stato combinato di ossido;
- le reazioni catodiche sono invece sempre reazioni di riduzione di alcuni ioni con corrispondente consumo degli elettroni prodotti dalla reazione anodica e transitati attraverso il metallo.
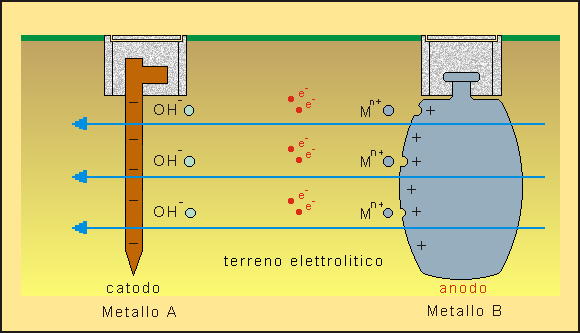
Fig. 2 - Corrosione elettrochimica
Il processo corrosivo di metalli interrati in terreno elettrolitico può sostanzialmente avvenire per i seguenti motivi:
metalli diversi a contatto fra loro;
metalli diversi collegati elettricamente fra loro;
metalli diversi in presenza di correnti continue;
metallo ricoperto da strati di terreno non omogeneo diversamente permeabili ai gas.
1. 2.1 Corrosione di contatto
Affinché il processo corrosivo si verifichi e necessario che i due metalli siano diversi e che siano in contatto fra di loro. In presenza di un suolo elettrolitico, se i due metalli hanno potenziali diversi (tab.1), si crea fra di loro una differenza di potenziale (coppia galvanica).
|
METALLO |
Potenziale elettrochimico
(V) |
|
Litio |
-3,02 |
|
Sodio |
-2,72 |
|
Magnesio |
-1,80 |
|
Alluminio |
-1,45 |
|
Manganese |
-1,10 |
|
Zinco |
-0,77 |
|
Cromo |
-0,56 |
|
Ferro |
-0,43 |
|
Cadmio |
-0,42 |
|
Nichel |
-0,20 |
|
Stagno |
-0,14 |
|
Piombo |
-0,13 |
|
Idrogeno |
0,0 |
|
Antimonio |
+0,2 |
|
Rame |
+0,35 |
|
Argento |
+0,80 |
|
Mercurio |
+0,86 |
|
Platino |
+0,87 |
|
Oro |
+1,5 |
Tab. 1 - Scala galvanica dei metalli di interesse elettrotecnico riferita all'elettrodo d'idrogeno
Gli elettroni si spostano dal metallo a potenziale minore verso quello a potenziale maggiore. In presenza di un ossidante, ad esempio ossigeno contenuto in terreno umido, questo verrà ridotto, anche sulla superficie del metallo a potenziale maggiore, sempre a spese degli elettroni del metallo a potenziale minore. Quanto più è negativo il potenziale del metallo, tanto più facile risulta la sua ossidazione. In figura 3 un collare di rame (catodo), più propenso a ridursi rispetto al ferro, in intimo contatto con un tubo di ferro (anodo), riceve gli elettroni che migrano verso di lui provenienti dal ferro. L'ossigeno che viene ridotto nei pressi del contatto si riduce tutto a spese degli elettroni dell'anodo di ferro mentre il rame funge da catodo inerte provocando l'accelerazione del processo di ossidazione localizzato nei pressi della zona di contatto fra i due metalli. Il rame non partecipa attivamente ad alcun processo, non si ossida e non si riduce, in questo caso l'ossidante è solamente l'ossigeno. Il risultato di tale processo è una circolazione di corrente tra anodo e catodo e una corrosione in prossimità della giunzione tra collare e tubo.
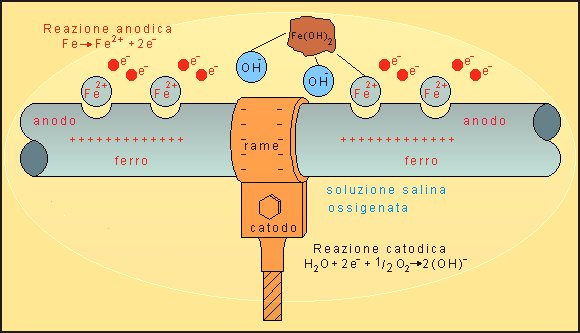
Fig. 3 - Corrosione fra metalli diversi a contatto immersi in soluzione elettrolitica
continua...